---->TODA LA MATERIA DEL UNIVERSO SE DEBE A LA COMBINACION DE LOS CASI 120 SUSTANCIAS BASICAS
---->EN 1865 SE CONOCIAN DE 27 A 63 ELEMENTOS
---->EN 1789 ANTONIE LAVOISIER PUBLICO SU OBRA MAS IMPORTANTE FIJANDO LOS FUNDAMENTOS DE LA QUIMICA COMO UNA DISCIPLINA , LAVOISIER PUBLICO LA PRIMERA TABLA PERIODICA
---->LOS CIENTIFICOS CONTRIBUYENTES FUERON :
>NEWLANDS 1864
>RUTHERFORD 1813
>MOSELEY 1815
>MENDELV 1864
>BERZELIEUS
martes, 18 de mayo de 2010
GRUPOS
Grupos
Artículo principal: Grupo de la tabla periódica
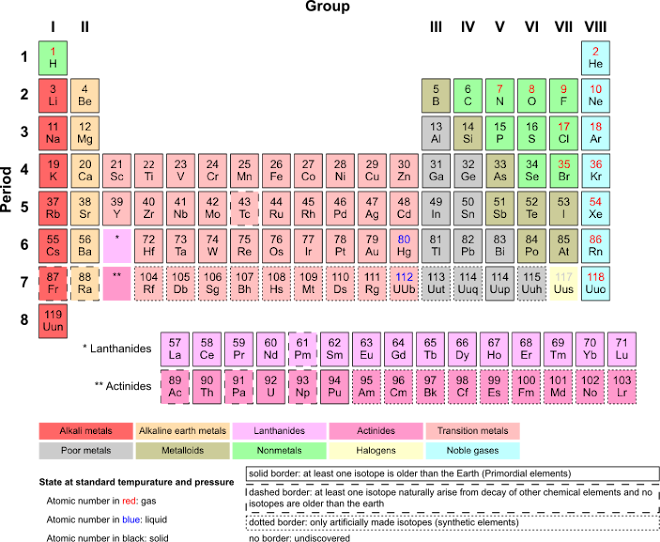
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos
Grupo 3 (III A): Familia del Escandio
Grupo 4 (IV A): Familia del Titanio
Grupo 5 (V A): Familia del Vanadio
Grupo 6 (VI A): Familia del Cromo
Grupo 7 (VII A): Familia del Manganeso
Grupo 8 (VIII): Familia del Hierro
Grupo 9 (VIII): Familia del Cobalto
Grupo 10 (VIII): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Grupo 13 (III B): los térreos
Grupo 14 (IV B): los carbonoideos
Grupo 15 (V B): los nitrogenoideos
Grupo 16 (VI B): los calcógenos o anfígenos
Grupo 17 (VII B): los halógenos
Grupo 18 (0): los gases nobles
Artículo principal: Grupo de la tabla periódica
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo, los elementos en el grupo IA tienen valencia de 1 (un electrón en su último nivel de energía) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
Grupo 1 (I A): los metales alcalinos
Grupo 2 (II A): los metales alcalinotérreos
Grupo 3 (III A): Familia del Escandio
Grupo 4 (IV A): Familia del Titanio
Grupo 5 (V A): Familia del Vanadio
Grupo 6 (VI A): Familia del Cromo
Grupo 7 (VII A): Familia del Manganeso
Grupo 8 (VIII): Familia del Hierro
Grupo 9 (VIII): Familia del Cobalto
Grupo 10 (VIII): Familia del Níquel
Grupo 11 (I B): Familia del Cobre
Grupo 12 (II B): Familia del Zinc
Grupo 13 (III B): los térreos
Grupo 14 (IV B): los carbonoideos
Grupo 15 (V B): los nitrogenoideos
Grupo 16 (VI B): los calcógenos o anfígenos
Grupo 17 (VII B): los halógenos
Grupo 18 (0): los gases nobles
LA TABLA DE MENDELEIEV
En 1869, el ruso Dmitri Ivánovich Mendeleiev publica su primera Tabla Periódica en Alemania. Un año después lo hace Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
Colocaron los elementos por orden creciente de sus masas atómicas.
Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
Tabla de Mendeléyev publicada en 1872. En ella deja casillas libres para elementos por descubrir.La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
Colocaron los elementos por orden creciente de sus masas atómicas.
Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
Tabla de Mendeléyev publicada en 1872. En ella deja casillas libres para elementos por descubrir.La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire.
LEY OCTAVAS DE NEWLANDS
Ley de las octavas de Newlands
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
LAS TRIADAS DE DOBEREINER
Triadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio.
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio.
LOS METALES , NO METALES Y METALOIDES
Metales, no metales y metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
LA HISTORIA DE LA TABLA PERIODICA
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
El descubrimiento de los elementos de la tabla periódica
El estudio de las propiedades comunes y la clasificación de los elementos.
El descubrimiento de los elementos de la tabla periódica
El estudio de las propiedades comunes y la clasificación de los elementos.
La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P).
En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy.
En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Suscribirse a:
Entradas (Atom)